Difference between revisions of "Práctica. Física y Química. N15. B. Compuestos binarios del hidrógeno. 2013"
Lunadelgado (Talk | contribs) (→Hidrácidos) |
MariaJesus (Talk | contribs) |
||
| (34 intermediate revisions by 6 users not shown) | |||
| Line 1: | Line 1: | ||
=== Introducción === | === Introducción === | ||
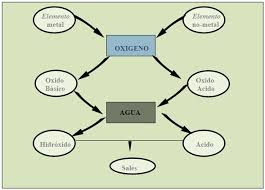
| − | El hidrógeno es uno de los pocos elementos químicos que se combina con casi todos los demás. Los compuestos resultantes de la unión del hidrógeno y otro elemento se | + | El hidrógeno es uno de los pocos elementos químicos que se combina con casi todos los demás. Los compuestos resultantes de la unión del hidrógeno y otro elemento se denominan '''hidruros''', con la excepción del flúor, el cloro, el bromo, el yodo, el azufre, el selenio, el teluro y el oxígeno (ver punto [[Práctica._Física_y_Química._N15._B._Compuestos_binarios_del_hidrógeno._2013#Compuestos_especiales|Compuestos especiales]]). |
| + | |||
| + | |||
| + | Aquí os vamos a enseñar un video explicándolo: | ||
| + | |||
| + | |||
| + | {{#ev:youtube|lDVvyIDG9ss}} | ||
=== Fórmula general === | === Fórmula general === | ||
| − | Los hidruros son compuestos binarios formados por hidrógeno y otro elemento. En la fórmula, el hidrógeno actúa con número de oxidación -1. | + | Los hidruros son compuestos binarios formados por hidrógeno y otro elemento. En la fórmula, el hidrógeno actúa con número de oxidación -1. Los números de oxidación de los elementos se intercambian, es decir, el elemento que se combina con el hidrógeno adquiere el número de oxidación de éste, y al hidrógeno se le pone el número de oxidación del elemento en cuestión. Esta sería su fórmula general: |
| − | '''XHnúmero de oxidación del elementoX'''[[File:Hidrag.jpg|thumbnail|left]] | + | '''XHnúmero de oxidación del elementoX'''[[File:Hidrag.jpg|500px|thumbnail|left]] |
| − | Existe una excepción, que sucede cuando el hidrógeno se combina con: cloro, bromo, yodo, azufre, selenio, | + | |
| + | Existe una excepción, que sucede cuando el hidrógeno se combina con: cloro, bromo, yodo, azufre, selenio, fluor o teluro. En cuyo caso se pone primero el hidrógeno con el número de oxidación del elemento con el que se une, y detrás el elemento usando el número de oxidación del hidrógeno. | ||
| + | |||
'''Hxnúmero de oxidación del elemento X''' | '''Hxnúmero de oxidación del elemento X''' | ||
| + | |||
Como por ejemplo: | Como por ejemplo: | ||
FeH<sub>3</sub> | FeH<sub>3</sub> | ||
| Line 12: | Line 21: | ||
=== Nomenclatura con números de oxidación === | === Nomenclatura con números de oxidación === | ||
| − | + | En la nomenclatura con prefijos multiplicadores se utilizan algunos prefijos, como: "mono-", "di-", "tri-", "tetra-", "penta-" "hexa-", "hepta-". | |
| + | |||
| + | En la nomenclatura con números de oxidación se indica el número de oxidación del elemento unido al hidrógeno mediante números romanos entre paréntesis, aunque, a veces, no es necesario ponerlo. | ||
| − | |||
'''Ejemplos''' | '''Ejemplos''' | ||
| + | |||
BeH<sub>2</sub>(di)hidruro de berilio o hidruro de berilio | BeH<sub>2</sub>(di)hidruro de berilio o hidruro de berilio | ||
| Line 29: | Line 40: | ||
FeH<sub>3</sub>trihidruro de hierro o Hidruro de hierro(III) | FeH<sub>3</sub>trihidruro de hierro o Hidruro de hierro(III) | ||
| − | |||
| − | NH<sub>3</sub> ''Amoniaco'' | + | Algunos compuestos binarios del hidrógeno reciben nombres comunes como: |
| + | |||
| + | NH<sub>3</sub> ''Amoniaco'' | ||
| + | |||
| + | H<sub>2</sub>O ''Agua'' | ||
| + | |||
| + | CH<sub>4</sub> ''Metano'' | ||
=== Compuestos especiales === | === Compuestos especiales === | ||
| − | Con algunos compuestos como el flúor, el cloro, el bromo,el yodo, el azufre, el selenio y el teluro | + | Con algunos compuestos como el flúor, el cloro, el bromo,el yodo, el azufre, el selenio y el teluro el hidrógeno actúa con numero de oxidación +1, y el átomo lo hace con su número de oxidación negativo. La fórmula general de estos compuestos se escribe de la siguiente manera: en primer lugar, el símbolo del hidrógeno con el número de oxidación del elemento X al que se une, y, a continuación, el símbolo de este elemento (X). |
| + | |||
Se nombran con el nombre del elemento seguido del sufijo "uro", seguidamente, se indica el hidrógeno. | Se nombran con el nombre del elemento seguido del sufijo "uro", seguidamente, se indica el hidrógeno. | ||
[[File:Compuestoshidrogeno.png|373x87px|thumbnail|center|Fórmula de los compuestos especiales]] | [[File:Compuestoshidrogeno.png|373x87px|thumbnail|center|Fórmula de los compuestos especiales]] | ||
| − | === | + | === Hidroácidos === |
| − | [[Category: | + | [[Category: Química]] |
[[Category: N15]] | [[Category: N15]] | ||
| − | Los | + | Los hidroácidos son las sustancias ácidas que se forman por la unión del hidrógeno con los elementos no metálicos. |
Se escribe primero el hidrógeno y después el elemento no metálico. | Se escribe primero el hidrógeno y después el elemento no metálico. | ||
Estos compuestos en agua dan disoluciones de carácter ácido y se conocen como ácidos | Estos compuestos en agua dan disoluciones de carácter ácido y se conocen como ácidos | ||
| − | + | hidroácidos y, así, por ejemplo, se nombran como: | |
| − | HF, ácido fluorhídrico. H<sub>2</sub>S, ácido sulfhídrico. | + | HF, ácido fluorhídrico. |
| + | |||
| + | H<sub>2</sub>S, ácido sulfhídrico. | ||
| − | |||
Son combinaciones de átomos H con átomos de Halógenos (F, Cl, Br, I) o Calcógenos (S, Se, Te), los que actúan con números de oxidación 1 y 2 respectivamente. Son compuestos moleculares gaseosos y su carácter ácido lo manifiestan cuando se disuelven en agua, dando soluciones ácidas. | Son combinaciones de átomos H con átomos de Halógenos (F, Cl, Br, I) o Calcógenos (S, Se, Te), los que actúan con números de oxidación 1 y 2 respectivamente. Son compuestos moleculares gaseosos y su carácter ácido lo manifiestan cuando se disuelven en agua, dando soluciones ácidas. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''NOMENCLATURA SISTEMÁTICA O STOCK''' | |
| − | + | Se nombran, agregando el sufijo -uro a la raíz del nombre del elemento no metálico, seguido de la preposición de y de la palabra hidrógeno. | |
| − | + | HF fluoruro de hidrógeno | |
| − | + | HCl cloruro de hidrógeno | |
| − | |||
| − | |||
| + | [[File:TABLA HIDRÁCIDOS.jpg|thumbnail|400px|none|Tabla de Hidrácidos.jpg]] | ||
| − | + | ===Práctica=== | |
| − | + | {{#ev:youtube|95o0l3KO22I}} | |
| − | + | === Fuentes de Información === | |
| − | + | '''Instrucciones para realizar el artículo''' | |
| − | + | ||
| − | + | * Garrido, Mª Jesús (2013). Práctica de Compuesto del hidrógeno. Consultado el 11 de marzo del 2014. | |
| − | + | ||
| − | + | ||
En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1 | En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1 | ||
| + | |||
| + | '''Webgrafía''' | ||
| + | |||
| + | * Mecánica de formación de los hidruros. Consultado el 25 de marzo de 2014. En http://www.monografias.com/trabajos95/compuestos-quimicos-inorganicos/compuestos-quimicos-inorganicos.shtml | ||
| + | |||
| + | * Jorge Marconi, Jorge. Los compuestos químicos inorgánicos. Consultado el 25 de Marzo, 2014. En: http://www.monografias.com/trabajos95/compuestos-quimicos-inorganicos/compuestos-quimicos-inorganicos.shtml | ||
| + | |||
| + | '''Imágenes''' | ||
| + | |||
| + | * Garrido, Mª Jesús (2013). Práctica de Compuesto del hidrógeno. Consultado el 11 de marzo del 2014. En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1 | ||
| + | |||
| + | * Tabla de Hidrácidos. Consultado el 25 de marzo de 2014. En: http://3.bp.blogspot.com/_8wPbBisleUQ/S5-i5vsbVYI/AAAAAAAAAaw/jWCurYM9ftI/s400/TABLA%20HIDR%C3%81CIDOS.bmp | ||
| + | |||
| + | '''Vídeos''' | ||
| + | |||
| + | * Ojelcjm (16 de Mayo de 2012). F5 Compuestos Binarios. Hidrógeno [Archivo de vídeo]. Consultado el 25 de marzo de 2014. En: https://www.youtube.com/watch?v=lDVvyIDG9ss | ||
Latest revision as of 09:27, 27 April 2017
Contents |
Introducción
El hidrógeno es uno de los pocos elementos químicos que se combina con casi todos los demás. Los compuestos resultantes de la unión del hidrógeno y otro elemento se denominan hidruros, con la excepción del flúor, el cloro, el bromo, el yodo, el azufre, el selenio, el teluro y el oxígeno (ver punto Compuestos especiales).
Aquí os vamos a enseñar un video explicándolo:
Fórmula general
Los hidruros son compuestos binarios formados por hidrógeno y otro elemento. En la fórmula, el hidrógeno actúa con número de oxidación -1. Los números de oxidación de los elementos se intercambian, es decir, el elemento que se combina con el hidrógeno adquiere el número de oxidación de éste, y al hidrógeno se le pone el número de oxidación del elemento en cuestión. Esta sería su fórmula general:
XHnúmero de oxidación del elementoXExiste una excepción, que sucede cuando el hidrógeno se combina con: cloro, bromo, yodo, azufre, selenio, fluor o teluro. En cuyo caso se pone primero el hidrógeno con el número de oxidación del elemento con el que se une, y detrás el elemento usando el número de oxidación del hidrógeno.
Hxnúmero de oxidación del elemento X
Como por ejemplo: FeH3 ZnH2
Nomenclatura con números de oxidación
En la nomenclatura con prefijos multiplicadores se utilizan algunos prefijos, como: "mono-", "di-", "tri-", "tetra-", "penta-" "hexa-", "hepta-".
En la nomenclatura con números de oxidación se indica el número de oxidación del elemento unido al hidrógeno mediante números romanos entre paréntesis, aunque, a veces, no es necesario ponerlo.
Ejemplos
BeH2(di)hidruro de berilio o hidruro de berilio
AlH3(tri)hidruro de aluminio o hidruro de aluminio
BaH2(di)hidruro de bario o hidruro de bario
CuH(mono)hidruro de cobre o Hidruro de cobre(I)
CuH2dihidruro de cobre o Hidruro de cobre(II)
FeH3trihidruro de hierro o Hidruro de hierro(III)
Algunos compuestos binarios del hidrógeno reciben nombres comunes como:
NH3 Amoniaco
H2O Agua
CH4 Metano
Compuestos especiales
Con algunos compuestos como el flúor, el cloro, el bromo,el yodo, el azufre, el selenio y el teluro el hidrógeno actúa con numero de oxidación +1, y el átomo lo hace con su número de oxidación negativo. La fórmula general de estos compuestos se escribe de la siguiente manera: en primer lugar, el símbolo del hidrógeno con el número de oxidación del elemento X al que se une, y, a continuación, el símbolo de este elemento (X).
Se nombran con el nombre del elemento seguido del sufijo "uro", seguidamente, se indica el hidrógeno.
Hidroácidos
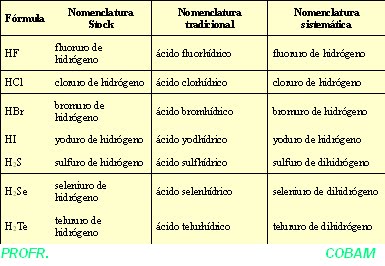
Los hidroácidos son las sustancias ácidas que se forman por la unión del hidrógeno con los elementos no metálicos. Se escribe primero el hidrógeno y después el elemento no metálico.
Estos compuestos en agua dan disoluciones de carácter ácido y se conocen como ácidos hidroácidos y, así, por ejemplo, se nombran como:
HF, ácido fluorhídrico.
H2S, ácido sulfhídrico.
Son combinaciones de átomos H con átomos de Halógenos (F, Cl, Br, I) o Calcógenos (S, Se, Te), los que actúan con números de oxidación 1 y 2 respectivamente. Son compuestos moleculares gaseosos y su carácter ácido lo manifiestan cuando se disuelven en agua, dando soluciones ácidas.
NOMENCLATURA SISTEMÁTICA O STOCK
Se nombran, agregando el sufijo -uro a la raíz del nombre del elemento no metálico, seguido de la preposición de y de la palabra hidrógeno.
HF fluoruro de hidrógeno
HCl cloruro de hidrógeno
Práctica
Fuentes de Información
Instrucciones para realizar el artículo
- Garrido, Mª Jesús (2013). Práctica de Compuesto del hidrógeno. Consultado el 11 de marzo del 2014.
En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1
Webgrafía
- Mecánica de formación de los hidruros. Consultado el 25 de marzo de 2014. En http://www.monografias.com/trabajos95/compuestos-quimicos-inorganicos/compuestos-quimicos-inorganicos.shtml
- Jorge Marconi, Jorge. Los compuestos químicos inorgánicos. Consultado el 25 de Marzo, 2014. En: http://www.monografias.com/trabajos95/compuestos-quimicos-inorganicos/compuestos-quimicos-inorganicos.shtml
Imágenes
- Garrido, Mª Jesús (2013). Práctica de Compuesto del hidrógeno. Consultado el 11 de marzo del 2014. En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1
- Tabla de Hidrácidos. Consultado el 25 de marzo de 2014. En: http://3.bp.blogspot.com/_8wPbBisleUQ/S5-i5vsbVYI/AAAAAAAAAaw/jWCurYM9ftI/s400/TABLA%20HIDR%C3%81CIDOS.bmp
Vídeos
- Ojelcjm (16 de Mayo de 2012). F5 Compuestos Binarios. Hidrógeno [Archivo de vídeo]. Consultado el 25 de marzo de 2014. En: https://www.youtube.com/watch?v=lDVvyIDG9ss