Práctica. Física y Química. N15. B. Compuestos binarios del hidrógeno. 2013
Contents |
Introducción
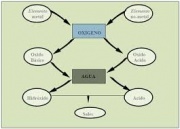
El hidrógeno es uno de los pocos elementos químicos que se combina con casi todos los demás. Los compuestos resultantes de la unión del hidrógeno y otro elemento se denomina hidruro, con la excepción del flúor, cloro, bromo, yodo, azufre, selenio, teluro y el oxígeno (ver punto Compuestos especiales )
Aquí os vamos a enseñar un video explicandolo:
Fórmula general
Los hidruros son compuestos binarios formados por hidrógeno y otro elemento. En la fórmula, el hidrógeno actúa con número de oxidación -1. Los números de oxidación de los elementos se intercambian, es decir, el elemento que se combina con el hidrógeno adquiere el número de oxidación de este, y al hidrógeno se le pone el número de oxidación del elemento en cuestión. Esta sería su fórmula general:
XHnúmero de oxidación del elementoXExiste una excepción, que sucede cuando el hidrógeno se combina con: cloro, bromo, yodo, azufre, selenio, fluo y teluro. En cuyo caso se pone primero el hidrógeno con el número de oxidación del elemento con el que se une, y detrás el elemento usando el número de oxidación del hidrógeno. Hxnúmero de oxidación del elemento X Como por ejemplo: FeH3 ZnH2
Nomenclatura con números de oxidación
La nomenclatura con prefijos multiplicadores se utilizan algunos prefijos, como: "mono-", "di-", "tri-", "tetra-", "penta-" "hexa-", "hepta-"
La nomenclatura con números de oxidación se indica el número de oxidación del elemento unido al hidrógeno mediante números romanos entre paréntesis, aunque, a veces no es necesario ponerlo.
Ejemplos BeH2(di)hidruro de berilio o hidruro de berilio
AlH3(tri)hidruro de aluminio o hidruro de aluminio
BaH2(di)hidruro de bario o hidruro de bario
CuH(mono)hidruro de cobre o Hidruro de cobre(I)
CuH2dihidruro de cobre o Hidruro de cobre(II)
FeH3trihidruro de hierro o Hidruro de hierro(III)
Algunos compuestos binarios del hidrogeno reciben nombres comunes como:
NH3 Amoniaco, H2O Agua, CH4 Metano
Compuestos especiales
Con algunos compuestos como el flúor, el cloro, el bromo,el yodo, el azufre, el selenio y el teluro; el hidrógeno actúa con numero de oxidación +1, y el átomo lo hace con su número de oxidación negativo.La fórmula general de estos compuestos, se escribe, en primer lugar, el símbolo del hidrógeno con el número de oxidación del elemento X al que se une, y a continuación el símbolo de este elemento (X). Se nombran con el nombre del elemento seguido del sufijo "uro", seguidamente, se indica el hidrógeno.
Hidrácidos
Los hidrácidos son las sustancias ácidas que se forman por la unión del hidrógeno con los elementos no metálicos. Se escribe primero el hidrógeno y después el elemento no metálico.
Estos compuestos en agua dan disoluciones de carácter ácido y se conocen como ácidos hidrácidos y, así, por ejemplo, se nombran como:
HF, ácido fluorhídrico. H2S, ácido sulfhídrico.
HIDRÁCIDOS.
Son combinaciones de átomos H con átomos de Halógenos (F, Cl, Br, I) o Calcógenos (S, Se, Te), los que actúan con números de oxidación 1 y 2 respectivamente. Son compuestos moleculares gaseosos y su carácter ácido lo manifiestan cuando se disuelven en agua, dando soluciones ácidas.
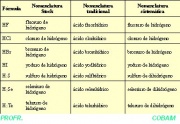
NOMENCLATURA TRADICIONAL:
Nombre genérico: Ácido
Nombre específico: sufijo -hídrico a la raíz del nombre del elemento no metálico.
HF ácido fluorhídrico
HCl ácido clorhídrico
HBr ácido bromhídrico
HI ácido yodhídrico
H2S ácido sulfhídrico
H2Se ácido selenhídrico
H2Te ácido telurhídrico
NOMENCLATURA SISTEMÁTICA O STOCK:
Se nombran, agregando el sufijo -uro a la raíz del nombre del elemento no metálico, seguido de la preposición de y de la palabra hidrógeno.
HF fluoruro de hidrógeno
HCl cloruro de hidrógeno
Bibliografia
Información: Garrido, Mª Jesús (2013). Práctica de Compuesto del hidrógeno.Consultado el 11 de marzo del 2014. En: https://docs.google.com/file/d/0B1DLmCdkVW6rRmFXR29Ca01MS00/edit?pli=1