Difference between revisions of "Ley de Boyle y Ley de Charles. N15"
Ireneariza (Talk | contribs) (→Jacques Charles) |
MariaJesus (Talk | contribs) |
||
| (65 intermediate revisions by 11 users not shown) | |||
| Line 2: | Line 2: | ||
== Introducción == | == Introducción == | ||
| + | Vamos a explicarles las leyes de Boyle y Charles, y para eso es necesario tener antes unos conceptos claros. | ||
| + | [[File:Presion.jpg|thumbnail]] | ||
| + | |||
| + | [[File:Intro.PNG|thumbnail]] | ||
| + | |||
| + | 1.¿Qué es la temperatura? | ||
| + | |||
| + | La temperatura es la medida de la energía cinética mediante átomos y moléculas que constituyen un sistema. Esta energía cinética depende de la [[Velocidad. N15|velocidad]], por lo que la temperatura está relacionada con las velocidades medias de las moléculas del gas. También podemos decir que la temperatura es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. | ||
| + | |||
| + | Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras. | ||
| + | |||
| + | 2.¿Qué es la presión? | ||
| + | |||
| + | La presión es la relación que existe entre una [[Fuerza. N15|fuerza]] y la superficie. | ||
| + | |||
| + | P = F/S | ||
| + | |||
| + | En el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el [[Metro (unidad de longitud). N15|metro]] cuadrado (m<sup>2</sup>). La unidad para la presión es el newton por [[Metro (unidad de longitud). N15|metro]] cuadrado (N/m<sup>2</sup>) que recibe el nombre de pascal (Pa) | ||
| + | |||
| + | 1 Pa = 1 N/m<sup>2</sup> | ||
| + | |||
| + | 3.¿Qué es el volumen? | ||
| + | |||
| + | El volumen es el espacio que ocupa un sistema. Por ejemplo, los gases ocupan todo el volumen disponible de un recipiente . Cuando el volumen de un recipiente que contiene un gas cambia, el volumen del gas cambia con el. | ||
| + | |||
== Biografías == | == Biografías == | ||
=== Jacques Charles === | === Jacques Charles === | ||
| − | '''Jacques Alexandre César Charles''' (12 de noviembre de 1746 - 7 de abril de 1823) fue un inventor, científico y matemático francés | + | [[File:Jacques Charles.jpg|framed|Jacques Charles]] |
| + | '''Jacques Alexandre César Charles''' (12 de noviembre de 1746 - 7 de abril de 1823) fue un inventor, científico y matemático francés. | ||
| + | Batió el record de globo aerostático, el 27 de agosto de 1783. Para esto propuso utilizar el hidrógeno,que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo. El 1 de diciembre de ese año, junto con Ainé Roberts, logró elevarse hasta una altura de 1.000 [[Metro (unidad de longitud). N15|metros]]. Fue una experiencia que supuso la locura por la aeronáutica que se desató en la época. | ||
| + | Entre sus logros se encuentra también el invento de varios dispositivos, entre ellos un densímetro (también llamado hidrómetro), aparato que mide la gravedad específica de los líquidos. | ||
| + | Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura. El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión, observando que por cada grado centígrado de aumento de la temperatura,el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja. | ||
| + | Dos generaciones más tarde, Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto. | ||
| + | Charles no público sus experimentos realizados en 1782, y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión. Por esto, a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac. | ||
| − | + | Charles fue electo en 1793 como miembro de la Académie des Sciences, instituto real de Francia. Fue profesor de Física hasta su muerte el 7 de abril de 1823. | |
=== Robert Boyle === | === Robert Boyle === | ||
| + | [[File:Boyle.jpg|200px|thumb|left|Robert Boyle]] | ||
| + | |||
| + | Nacido el 25 de enero de 1627, el menor de los catorce hijos del conde de Cork, estudió en las mejores universidades de Europa. Descubrió los indicadores, sustancias que permiten distinguir los ácidos de las bases. En 1659, con la ayuda de Robert Hooke, descubrió la ley que rige el comportamiento de los muelles, perfeccionó la bomba de aire para hacer el vacío que se utilizó en la minería para eliminar el agua de las galerías en las que trabajan los mineros. | ||
| + | Definió la Química como una ciencia y enunció la primera definición moderna de elemento químico. | ||
| + | Publicó el primer libro moderno de química “El Químico Escéptico” en el que explicaba la mayoría de sus descubrimientos. Fue miembro de la Royal Society, institución que perdura en la actualidad, y participó activamente en sus reuniones hasta su fallecimiento. | ||
| + | En una obra titulada Sobre la Elasticidad del Aire anunció su descubrimiento sobre la relación entre el volumen de un gas y su presión. | ||
| + | Trabajo en la universidad de Oxford como asistente de Robert Hooke, y juntos descubrieron la características físicas del aire. | ||
| + | Falleció el 31 de diciembre de 1691. | ||
| + | |||
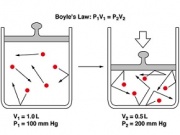
== Ley de Boyle == | == Ley de Boyle == | ||
| + | |||
| + | La ley de Boyle (también conocida como Ley de Boyle-Mariotte) fue descubierta por Robert Boyle y Edme Mariotte. | ||
| + | Relaciona el volumen y la presión de una cantidad de gas mantenida a una temperatura constante. | ||
| + | La ley dice que a temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce, resumidamente que cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. | ||
| + | La ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal (sus partículas no interactúan entre sí) | ||
| + | |||
| + | [[File:Boyleeee.jpg|framed]] | ||
| + | |||
== Ley de Charles == | == Ley de Charles == | ||
| + | La Ley de Charles relaciona el volumen y la temperatura de un gas a presión constante. | ||
| + | La ley dice que al aumentar la temperatura del gas, el volumen aumenta de forma proporcional. Esto se debe a que la temperatura está directamente relacionada con el movimiento de las moléculas del gas. | ||
| + | |||
== Videos == | == Videos == | ||
| + | {{#ev:youtube|O1Lu3RUCJnA}} | ||
| + | |||
=== Experimento 1 === | === Experimento 1 === | ||
| + | {{#ev:youtube|K8uRDVm6Ht0}} | ||
| + | {{#ev:youtube|87p-e3doLS0}} | ||
| + | |||
=== Experimento 2 === | === Experimento 2 === | ||
| − | + | {{#ev:youtube|PnVlyzTp0H8}} | |
| − | + | {{#ev:youtube|svQ-_Z_OJ2E}} | |
| + | |||
== Bibliografía == | == Bibliografía == | ||
| + | Biografía de Boyle (2014). ''Junta de Andalucía''. Consultado el 2 de marzo de 2014. En: http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/bio_boyle.html | ||
| + | |||
| + | Ley de boyle (2014). ''Educaplus''. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/play-117-Ley-de-Boyle.html | ||
| + | |||
| + | Leyes de los gases (2014). ''Educaplus''. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/gases/index.html | ||
| + | |||
| + | Volumen (2014). ''Wikipedia: La enciclopedia libre''. Consultado el 2 de marzo de 2014. En: http://es.wikipedia.org/wiki/Volumen | ||
| + | |||
| + | Leyes de los gases (2014). ''Educaplus''. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/gases/index.html | ||
| + | |||
| + | Imagen Volumen (2014). Consultado el 2 de marzo de 2014. En: http://es.wikipedia.org/wiki/Volumen | ||
| + | Imagen Jacques Charles (2014). Consultado el 2 de marzo de 2014. En: http://www.comicbookreligion.com/?c=8859 | ||
| + | Imagen Robert Boyle (2014. Consultado el 2 de marzo de 2014. En: http://en.wikipedia.org/wiki/Robert_Boyle | ||
| + | Imagen Presión (2014). Consultado el 2 de marzo de 2014. En: http://163.178.103.176/Fisiologia/respiratorio/pracb_1/respi_pracb_3.html | ||
| − | [[Category: | + | [[Category: Química]] |
[[Category: N15]] | [[Category: N15]] | ||
Latest revision as of 11:27, 26 April 2017
Contents |
Introducción
Vamos a explicarles las leyes de Boyle y Charles, y para eso es necesario tener antes unos conceptos claros.
1.¿Qué es la temperatura?
La temperatura es la medida de la energía cinética mediante átomos y moléculas que constituyen un sistema. Esta energía cinética depende de la velocidad, por lo que la temperatura está relacionada con las velocidades medias de las moléculas del gas. También podemos decir que la temperatura es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
2.¿Qué es la presión?
La presión es la relación que existe entre una fuerza y la superficie.
P = F/S
En el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2). La unidad para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
1 Pa = 1 N/m2
3.¿Qué es el volumen?
El volumen es el espacio que ocupa un sistema. Por ejemplo, los gases ocupan todo el volumen disponible de un recipiente . Cuando el volumen de un recipiente que contiene un gas cambia, el volumen del gas cambia con el.
Biografías
Jacques Charles
Jacques Alexandre César Charles (12 de noviembre de 1746 - 7 de abril de 1823) fue un inventor, científico y matemático francés. Batió el record de globo aerostático, el 27 de agosto de 1783. Para esto propuso utilizar el hidrógeno,que era el gas más ligero que se conocía entonces, como medio más eficiente que el aire para mantener los globos en vuelo. El 1 de diciembre de ese año, junto con Ainé Roberts, logró elevarse hasta una altura de 1.000 metros. Fue una experiencia que supuso la locura por la aeronáutica que se desató en la época. Entre sus logros se encuentra también el invento de varios dispositivos, entre ellos un densímetro (también llamado hidrómetro), aparato que mide la gravedad específica de los líquidos. Su descubrimiento más importante fue en realidad un redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y demostró que los gases se expandían de la misma manera al someterlos a un mismo incremento de temperatura. El paso que avanzó Charles fue que midió con más o menos exactitud el grado de expansión, observando que por cada grado centígrado de aumento de la temperatura,el volumen del gas aumentaba 1/275 del que tenía a 0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja. Dos generaciones más tarde, Kelvin fijó estas ideas desarrollando la escala absoluta de temperaturas y definiendo el concepto de cero absoluto. Charles no público sus experimentos realizados en 1782, y hacia 1802 Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la temperatura cuando se mantiene constante la presión. Por esto, a la ley de Charles también se le llama a veces ley de Charles y Gay-Lussac.
Charles fue electo en 1793 como miembro de la Académie des Sciences, instituto real de Francia. Fue profesor de Física hasta su muerte el 7 de abril de 1823.
Robert Boyle
Nacido el 25 de enero de 1627, el menor de los catorce hijos del conde de Cork, estudió en las mejores universidades de Europa. Descubrió los indicadores, sustancias que permiten distinguir los ácidos de las bases. En 1659, con la ayuda de Robert Hooke, descubrió la ley que rige el comportamiento de los muelles, perfeccionó la bomba de aire para hacer el vacío que se utilizó en la minería para eliminar el agua de las galerías en las que trabajan los mineros. Definió la Química como una ciencia y enunció la primera definición moderna de elemento químico. Publicó el primer libro moderno de química “El Químico Escéptico” en el que explicaba la mayoría de sus descubrimientos. Fue miembro de la Royal Society, institución que perdura en la actualidad, y participó activamente en sus reuniones hasta su fallecimiento. En una obra titulada Sobre la Elasticidad del Aire anunció su descubrimiento sobre la relación entre el volumen de un gas y su presión. Trabajo en la universidad de Oxford como asistente de Robert Hooke, y juntos descubrieron la características físicas del aire. Falleció el 31 de diciembre de 1691.
Ley de Boyle
La ley de Boyle (también conocida como Ley de Boyle-Mariotte) fue descubierta por Robert Boyle y Edme Mariotte. Relaciona el volumen y la presión de una cantidad de gas mantenida a una temperatura constante. La ley dice que a temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce, resumidamente que cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. La ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal (sus partículas no interactúan entre sí)
Ley de Charles
La Ley de Charles relaciona el volumen y la temperatura de un gas a presión constante. La ley dice que al aumentar la temperatura del gas, el volumen aumenta de forma proporcional. Esto se debe a que la temperatura está directamente relacionada con el movimiento de las moléculas del gas.
Videos
Experimento 1
Experimento 2
Bibliografía
Biografía de Boyle (2014). Junta de Andalucía. Consultado el 2 de marzo de 2014. En: http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/bio_boyle.html
Ley de boyle (2014). Educaplus. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/play-117-Ley-de-Boyle.html
Leyes de los gases (2014). Educaplus. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/gases/index.html
Volumen (2014). Wikipedia: La enciclopedia libre. Consultado el 2 de marzo de 2014. En: http://es.wikipedia.org/wiki/Volumen
Leyes de los gases (2014). Educaplus. Consultado el 2 de marzo de 2014. En: http://www.educaplus.org/gases/index.html
Imagen Volumen (2014). Consultado el 2 de marzo de 2014. En: http://es.wikipedia.org/wiki/Volumen
Imagen Jacques Charles (2014). Consultado el 2 de marzo de 2014. En: http://www.comicbookreligion.com/?c=8859
Imagen Robert Boyle (2014. Consultado el 2 de marzo de 2014. En: http://en.wikipedia.org/wiki/Robert_Boyle
Imagen Presión (2014). Consultado el 2 de marzo de 2014. En: http://163.178.103.176/Fisiologia/respiratorio/pracb_1/respi_pracb_3.html