Modelos atómicos. N15
Contents |
Introducción
¿Qué es un átomo?
Los átomos son la unidad básica de toda la materia, la estructura que define a todos los elementos y tiene propiedades químicas bien definidas. Todos los elementos químicos de la tabla periódica están compuestos por átomos con exáctamente la misma estructura y a su vez, éstos se componen de tres tipos de partículas, como los protones (carga positiva) y los neutrones (sin carga), que se encuentran en la parte central y tienen una masa muy similar) y los electrones (masa mayor y carga positiva), que se encuentran en una especie de órbita alrededor del núcleo que es el centro del átomo, siendo este la parte más pequeña de él y el lugar donde se conservan todas sus propiedades químicas. Además, casi toda la masa del átomo reside en él.Las partes del átomo no son posibles de dividir mediante procesos químicos y siempre habrá el mismo número de electrones que de protones ya que los átomos no tienen carga.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isótopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
El concepto moderno (Teoría atómica moderna) sobre los átomos proviene de distintos sectores de los campos de la física y la química. Las primeras ideas al respecto surgieron en la Antigua Grecia, desde las ciencias y la filosofía, que luego se desarrollaron por completo en la química de los siglos XVIII y XIX. Desde la época de los antiguos griegos hasta nuestros días, hemos reflexionado profundamente acerca de qué cosa está hecha la materia.
Hoy sabemos que los átomos son la unidad mínima de una sustancia, lo que compone toda la materia común y ordinaria. Si los átomos de una sustancia se dividen, la identidad de esa tal puede destruirse y cada sustancia tiene diferentes cantidades de átomos que la componen.
Evolución sobre su teoría
No siempre se ha tenido el mismo modelo atómico sino que la ciencia ha ido dando respuestas cada vez más evolucionadas según los experimentos.
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
Hubo muchos científicos y químicos que realizaron descubrimientos y utilizaron estas teorías para explicar el concepto de átomo y entender su naturaleza. De entre todos ellos destacan:
John Dalton (1808) utilizó la imagen del átomo de Dalton en su teoría atómica para explicar estas leyes. Decía que las células son minúsculas partículas esféricas, indivisibles e inmutables,iguales entre sí en cada elemento químico.
J.J. Thomsom (1897) demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones (modelo atómico de Thomson).
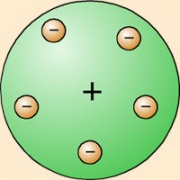
E. Rutherford (1911) dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente (modelo atómico de Rutherford).
Niels Bohr (1913) Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos (modelo atómico de Bohr).
Modelos desde la Antigua Grecia
El concepto de átomo fue introducido por los filósofos de la antigua Grecia como: la partícula a la que se llega por sucesivas divisiones de la materia, pero que en sí misma es indivisible. Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía.
La hipótesis fue introducida en la ciencia moderna con John Dalton (1766-1844), estableciendo una conexión firme entre el concepto de átomo y el concepto de elemento químico. Para Dalton las sustancias simples o elementos están formados por átomos iguales entre sí, pero diferentes de un elemento a otro, y por tanto sus propiedades también. Las sustancias compuestas están formadas por átomos compuestos llamados moléculas, formados por la unión de dos o más átomos simples y distintos.
La moderna teoría atómica, al aclarar en qué consiste la estructura interna del átomo, ha precisado el concepto de elemento químico propuesto por Dalton. La definición actual de elemento químico es la de una sustancia compuesta por átomos que poseen un número atómico idéntico y característico de cada elemento. Esta definición, que hace referencia a la estructura del átomo, reemplaza a lo dicho por Boyle; sustancia que no puede descomponerse en otras más simples.
Sin embargo, los diferentes descubrimientos sobre la física de finales de siglo establecía la existencia de partículas aún más pequeñas que los átomos. En 1885 Henry Becquerel (1852-1908) observó, de forma expontánea, que unos minerales de uranio emitían radiaciones que eran capaces de impresionar las placas fotográficas y "meter" electricidad en el aire convirtiéndolo en conductor. Esta propiedad definida inicialmente para las sales de uranio y de torio recibió el nombre de radiactividad.
Modelos atómicos de Demócrito a Thompson
En la Antigua Grecia, se dieron las primeras definiciones de qué es la materia y qué la compone, llegando a ser completamente contradictorias:
Demócrito
(460-370 a.C)"Aparte de átomos y espacio vacío nada existe; lo demás es opinión". Demócrito fue el primer materialista (atomista) y se dio cuenta de que cada sustancia estaba hecha por cosas invisibles, a las que llamo "átomos" (del griego "indivisible"). Dijo que todas las cosas estaban constituidas por átomos y que entre los propios átomos existe el vacío. También afirmó que cada tipo de sustancia estaba compuesta de diferente tipo de átomos que las demás, es decir, afirmó que los átomos de cada sustancia son diferente. Demócrito fue el primer ateo, dudando de la existencia de Dios y presentando la materia como autocreada. Se dice que fue discípulo de Leucipo al que se le atribuyen las obras La ordenación del cosmos y Sobre la mente aunque este segundo libro pudo ser un capítulo de la obra anterior. No obstante, también es posible que Leucipo nunca existiera y que fuese una invención de Demócrito para ganar prestigio.
Aristóteles
(384-322 a.C) La primera contradicción entre teorías viene con Aristóteles, el cual creía que existían cuatro elementos: Fuego, agua, aire y tierra. Aristóteles estaba convencido de que cada propiedad que tienen las sustancia, se debe a una combinación de los 4 elementos en mayor o menor proporción.La teoría de los cuatro elementos fue la seguida durante varios siglos, llamandola "teoría aristotélica". Los alquimistas (primitivos químicos que seguían la teoría aristotélica), intentaban obtener la Piedra Filosofal, sustancia que les permitiría transmutar los metales en oro, curar cualquier enfermedad y evitar, incluso, la vejez y la muerte, a partir de estos cuatro elementos. Las investigaciones de Aristóteles, dieron lugar a la síntesis de numerosos compuestos (ácido clorhídrico, sulfúrico o nítrico), el descubrimiento de técnicas metalúrgicas, la producción de tintes, pinturas o cosméticos… etc.
John Dalton
(1766-1844 d.C) En 1808 recupera la teoría de Demócrito, diciendo que los átomos eran partículas invisibles que cuando se combinan forman otros compuestos, sin embargo, esta no fue aceptada por la comunidad científica hasta 100 años después. La teoría de Dalton compitió durante todo el siglo XIX con otra teoría basada en "los pesos equivalentes" de las sustancias.
J.J.Thomson
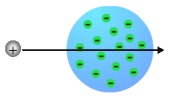
A finales del siglo XIX una serie de experimentos sobre la conducción de la electricidad por los gases, dio como resultado el descubrimiento de los Rayos Catódicos, extraña luz procedente de los polos negativos o cátodos (De ahí el nombre), la cual llenaba los tubos sometidos a altos voltajes. Estos rayos catódicos fueron expuestos a unas pruebas que demostraron que su procedencia no era la misma que la de la luz del Sol. En 1897 Thompson consiguió demostrar que esta luz estaba formada de partículas, con masa y carga negativa, a las que se llamo electrones. Estos electrones saltaban de los átomos del gas que contenían los tubos cuando eran sometidos a altos voltajes. Esto demostró que los átomos no son invisibles. En ese momento, Thomson propone el primer modelo atómico, en el que dice que los electrones, pequeñas partículas con carga negativa (Amarillas en la imagen), se encuentran en una nube de carga positiva (Verde en la imagen) de forma que los electrones se compensan con la nube positiva, quedándose eléctricamente neutro el átomo
Modelo atómico de Rutherford
En 1991, Rutheford decide hacer un experimento con el que demostrar la validez (o no) del modelo atómico de Thomson. Una forma de definir el experimento es: Unas partículas, llamadas partículas alfa (Procedentes de un material radiactivo) y son aceleradas y se hacen chocar contra una fina lámina de oro. Tras pasar a través de la lámina, las partículas alfa chocan contra una pantalla recubierta en su interior de sulfuro de zinc, creándose un chispazo. Gracias a esto, se puede observar si las partículas sufrían alguna desviación al atravesar la lámina. Las "partículas alfa" son núcleos de helio (por esta razón son extremadamente pequeñas e invisibles a la observación directa) y cuyas características principales son:
1.Su masa es, más o menos, 8.000 veces la de un electrón.
2.Tienen carga eléctrica positiva.
Los resultados del experimento pueden sintetizarse de este modo:
-Casi todas las partículas alfa atravesaban la lámina de oro sin sufrir ninguna desviación.
-Muy pocas (una de cada 10.000 aproximadamente) se desviaba un ángulo de más de 100º.
-En muy extrañas ocasiones las partículas alfa rebotaban en la lámina.
La interpretación dada por Rutherford fue esta: "Si el modelo atómico propuesto por Thomson fuera cierto no deberían observarse desviaciones ni rebotes de las partículas incidentes. Éstas atravesarían limpiamente los átomos sin desviarse".
Para que las partículas se desvíen, deben encontrar en su trayectoria una zona cuya masa sea igual o mayor a la de las partículas incidentes. Esta zona deberá tener, además, una carga positiva.
La zona en la que se concentra la masa y la carga positiva debería de ser muy pequeña si comparamos su volumen con el correspondiente a la totalidad del átomo.
La carga eléctrica (negativa) de los electrones debería estar exactamente compensada con la positiva del núcleo, ya que los átomos son eléctricamente neutros (carga cero).
Los resultados del experimento pueden entenderse si pensamos que un modelo planetario de átomo, con un núcleo central (muy pequeño en comparación con el átomo), en el que se concentra la masa y la carga positiva. Los electrones rotarían (de forma igual a como lo hacen los planetas alrededor del Sol) en órbitas concéntricas alrededor de este núcleo. Entre el núcleo y los electrones no hay materia, hay vacío. Si damos como bueno este modelo, los resultados del experimento de Rutherford pueden explicarse fácilmente:
-La mayor parte de las partículas alfa traviesan los átomos sin desviarse, ya que la mayor parte del volumen del átomo es espacio vacío. -Si la partícula incidente pasa cerca del núcleo (cosa poco probable, ya que el tamaño del núcleo es 10.000 veces menor que el del átomo) es repelida por éste. -Habrá un pequeño porcentaje de partículas que choquen directamente con el núcleo (probabilidad muy baja dada la pequeñez del núcleo), produciéndose un rebote.
Desde Rutherford hasta hoy
El modelo de Bohr
El modelo de Bohr El origen de los espectros era desconocido hasta que la teoría atómica asoció la emisión de radiación por parte de los átomos con el comportamiento de los electrones, en concreto con la distancia a la que éstos se encuentran del núcleo. El físico danés Niels Bohr ( Premio Nobel de Física 1922), propuso un nuevo modelo atómico que se basa en tres postulados
Primer Postulado:Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía.
Segundo Postulado:Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p. siendo "h" la constante de Planck, m la masa del electrón, v su velocidad, r el radio de la órbita y n un número entero (n=1, 2, 3, ...) llamado número cuántico principal, que vale 1 para la primera órbita, 2 para la segunda, etc.
Tercer postulado: Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética. Mientras el electrón se mueve en cualquiera de esas órbitas no radia energía, sólo lo hace cuando cambia de órbita. Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía, y la absorbe cuando pasa de una órbita interna a otra más externa.
En resumen podemos decir que los electrones se disponen en diversas órbitas circulares que determinan diferentes niveles de energía. Cada órbita se corresponde con un nivel energético que recibe el nombre de número cuántico principal, se representa con la letra " n " y toma valores desde 1 hasta 7 . La teoría de Bohr predice los radios de las órbitas permitidas en un átomo de hidrógeno. rn=n2a0, dónde n= 1, 2, 3, ... y a0=0.53 Å (53 pm) La teoría también nos permite calcular las velocidades del electrón en estas órbitas, y la energía. Por convenio, cuando el electrón está separado del núcleo se dice que está en el cero de energía. Cuando un electrón libre es atraído por el núcleo y confinado en una órbita n, la energía del electrón se hace negativa.Normalmente el electrón en un átomo de hidrógeno se encuentra en la órbita más próxima al núcleo (n=1). Esta es la energía permitida más baja, o el estado fundamental. Cuando el electrón adquiere un cuanto de energía pasa a un nivel más alto (n=2,3, ...) se dice entonces que el átomo se encuentra en un estado excitado. En este estado excitado el átomo no es estable y cuando el electrón regresa a un estado más bajo de energía emite una cantidad determinada de energía, que es la diferencia de energía entre los dos niveles.
Modelo definitivo
El modelo definitivo estaba compuesto por:
1.La presencia de un núcleo atómico con las partículas conocidas, la casi totalidad de la masa atómica en un volumen muy pequeño.
2.Los estados estacionarios o niveles de energía fundamentales en los cuales se distribuyen los electrones de acuerdo a su contenido energético.
3.La dualidad de la materia (carácter onda-partícula), aunque no tenga consecuencias prácticas al tratarse de objetos de gran masa. En el caso de partículas pequeñas (electrones) la longitud de onda tiene un valor comparable con las dimensiones del átomo.
4.La probabilidad en un lugar de certeza, en cuanto a la posición, energía y movimiento de un electrón, debido a la imprecisión de los estudios por el uso de la luz de baja frecuencia.
Bibliografía
Fer P.(17/6/2013). ¿Qué es un átomo?. Ojocientífico.com. Consultado el 19/02/2014. En: http://www.ojocientifico.com/4442/que-es-un-atomo
Mariano Gaite (27/11/2006). Historia: modelos atómicos. Concurso CNICE 2005. Consultado el 19/02/2014. En: http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/modelos.htm
Átomo (15/03/2014). Wikipedia: La enciclopedia libre. Consultado el 19/03/2014. En: http://es.wikipedia.org/wiki/%C3%81tomo
Ninibeth Bravo, Constanza Bustamante y Valeria Zapata. (2009). Inicios del átomo. El Átomo desde la Antigua Grecia hasta la actualidad. Consultado el 19/02/2014. En: http://discursoexelatomo.blogspot.com.es/
Luis Ignacio García González (16/03/2014). Átomos y electrones. Consultado el 19/02/14.En: http://web.educastur.princast.es/proyectos/fisquiweb/atomo/atomoI_B.htm
Escuela de Ingenierías Industriales (24/2/2009) Modelo atómico de Bohr. UVa. Consultado el 19/3/2014. En: http://www.eis.uva.es/~qgintro/atom/tutorial-08.html
Rcsmatheus (02/4/2014). Historia del Modelo Atómico. Monografías.com. Consultado el 2/4/2014. En: http://www.monografias.com/trabajos14/modelo-atomico/modelo-atomico.shtml#ACTUAL
Modelo atómico de Sommerfeld (10/2/2014). Wikipedia: La enciclopedia libre. Consultado el 2/04/2014. En:http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Sommerfeld
Modelo atómico de Schrödinger (23/3/2014). Wikipedia: La enciclopedia libre. Consultado el 2/04/2014. En: http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Schr%C3%B6dinger
Ecuación de Dirac (25 feb 2014). Wikipedia: La enciclopedia libre. Consultado el 2/04/2014. En: http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Dirac#.C3.81tomo_hidrogenoide_relativista