Práctica. Física y Química. N15. B.Compuestos binarios del oxígeno. 2013
Contents |
1 Introducción
Combinaciones binarias del oxígeno
El oxígeno se combina con todos los elementos químicos, excepto con los gases nobles, formando unos compuestos que se conocen como óxidos. El oxígeno siempre actúa con su número de oxidación -2 y el elemento con el que se combina lo hace con número de oxidación positivo. Si el elemento en cuestión tiene más de un número de oxidación positivo, podrá formar dos o más óxidos diferentes. Como por ejemplo:
Aquí tenéis un vídeo explicando cómo se forman los compuestos:
2 Cómo se formula
Para formular los óxidos se escribe en primer lugar el símbolo del elemento que se combina con el oxígeno y después el símbolo del oxígeno. Como subíndices, se intercambian los números de oxidación de estos dos elementos, sin poner el signo. Así, para un elemento X cualquiera, la fórmula del óxido se escribiría:
X2O número de oxidación del elemento X
Si se puede, se simplifican los subíndices. El subíndice 1 no se escribe.
Cu2O, Al2O3, Na2O, N2O5, Ca2O2, CaO, Si2O4, SiO2
3 Nomenclatura
a) Con prefijos
La nomenclatura con prefijos se nombra de la siguiente manera:
- Todos los compuestos binarios del oxígeno se nombran con la palabra óxido de...
- La palabra "óxido" van preferidos de los prefijos griegos: mono, dí, trí, tetra, penta, ...
- Los prefijos dependen según el número de átomos que tenga.
- Los prefijos no son necesarios para nombrar compuestos binarios,es decir, cuando solo hay un óxido del elemento.
Por ejemplo: Cu2O, que sería, óxido de dícobre, ya que el cobre también actua con otros óxidos
b) Con números de oxidación
El nombre comienza con óxido de...,seguido del nombre del otro elemento y su número de oxidación, que se indica con números romanos, entre paréntesis. Si el elemento que se combina con el oxígeno tiene un solo número de oxidación, no es necesario indicarlo.
Cu2O, óxido de cobre.
CuO, óxido de cobre(II)
Al2O3, óxido de aluminio
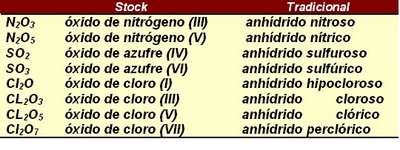
N2O5, óxido de nitrógeno(V)
Cl2O3, óxido de cloro(III)
SnO2, óxido de estaño(IV)
Bibliografía
INFORMACIÓN: Práctica: Compuestos binarios del oxígeno, 11/02/2014 . Consultado el día 11/03/2014. https://docs.google.com/file/d/0B1DLmCdkVW6rNmZtc1BNR0ExV1E/edit?pli=1
IMÁGENES: Escuela de Ingenierías Industriales. Consultado el día el 11 de febrero del 2014. http://www.eis.uva.es/~qgintro/nomen/imagenes/oxidos1.gif
Quimicasairaromeros.blogspot.comdomingo (12 de mayo de 2013),Quimica Saira Romero 10-1. http://quimicasairaromeros.blogspot.com.es/2013_05_01_archive.html. Consultado el 11 de Febrero del 2014.
VÍDEOS: TuTutor2014 (15/10/2013).Óxidos Básicos, Nomenclatura, Estructura de Lewis - Tutorial.Consultado el día 11/02/14 http://www.youtube.com/watch?v=EkfXpEOEbPI