Difference between revisions of "Práctica. Física y Química. N15. B.Compuestos binarios del oxígeno. 2013"
(→b) Con números de oxidación) |
(→b) Con números de oxidación) |
||
| Line 35: | Line 35: | ||
El nombre comienza con óxido de...,seguido del nombre del otro elemento y su número de oxidación, que se indica con números | El nombre comienza con óxido de...,seguido del nombre del otro elemento y su número de oxidación, que se indica con números | ||
romanos, entre paréntesis. Si el elemento que se combina con el oxígeno tiene un solo número de oxidación, no es necesario indicarlo. | romanos, entre paréntesis. Si el elemento que se combina con el oxígeno tiene un solo número de oxidación, no es necesario indicarlo. | ||
| − | + | Cu<sub>2</sub>O, óxido de cobre. | |
CuO, óxido de cobre(II) | CuO, óxido de cobre(II) | ||
| − | + | Al<sub>2</sub>O<sub>3</sub>, óxido de aluminio | |
N2<sub>Texto suscrito</sub>O5<sub>Texto suscrito</sub>, óxido de nitrógeno(V) | N2<sub>Texto suscrito</sub>O5<sub>Texto suscrito</sub>, óxido de nitrógeno(V) | ||
| − | + | Cl<sub>2</sub>O<sub>3</sub>, óxido de cloro(III) | |
| − | + | SnO<sub>2</sub>, óxido de estaño(IV) | |
[[Category: Física y Química]] | [[Category: Física y Química]] | ||
[[Category: N15]] | [[Category: N15]] | ||
Revision as of 15:13, 14 January 2014
Contents |
1 Introducción
Combinaciones binarias del oxígeno
El oxígeno se combina con todos los elementos químicos, excepto con los gases nobles, formando unos compuestos que se conocen como óxidos.El oxígeno siempre actúa con su número de oxidación -2 y el elemento con el que se combina lo hace con número de oxidación positivo. Si el elemento en cuestión tiene más de un número de oxidación positivo, podrá formar dos o más óxidos diferentes.Como por ejemplo;
2 Cómo se formula
Para formular los óxidos se escribe en primer lugar el símbolo del elemento que se
combina con el oxígeno y después el símbolo del oxígeno. Como subíndices, se intercambian
los números de oxidación de estos dos elementos, sin poner el signo. Así, para un elemento
X cualquiera, la fórmula del óxido se escribiría:
X2O número de oxidación del elemento X
Si se puede, se simplifican los subíndices. El subíndice 1 no se escribe.
Cu2O, Al2O3, Na2O, N2O5
Ca2O2 CaO Si2O4 SiO2
3 Nomenclatura
a) Con prefijos
La nomenclatura con prefijos se nombra de la siguiente manera:
- Todos los compuestos binarios del oxígeno se nombran con la palabra óxido de...
- Va preferido de los prefijos griegos: mono,dí,trí,tetra,penta,...
- Los prefijos van dependiendo según el número de átomos que tenga.
- Los prefijos no son necesarios para nombrar compuestos binarios,es decir, cuando solo hay un óxido del elemento.
Por ejemplo: Cu2O,que sería,óxido de dícobre, ya que el cobre también actua con otros óxidos
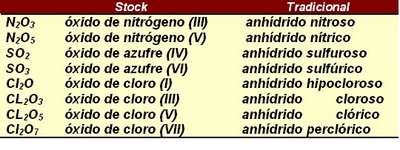
b) Con números de oxidación
El nombre comienza con óxido de...,seguido del nombre del otro elemento y su número de oxidación, que se indica con números romanos, entre paréntesis. Si el elemento que se combina con el oxígeno tiene un solo número de oxidación, no es necesario indicarlo. Cu2O, óxido de cobre.
CuO, óxido de cobre(II)
Al2O3, óxido de aluminio
N2Texto suscritoO5Texto suscrito, óxido de nitrógeno(V)
Cl2O3, óxido de cloro(III)
SnO2, óxido de estaño(IV)