Práctica. Física y Química. Compuestos del oxígeno con halógenos. 2013. N15
Contents |
Introducción
El flúor, el cloro, el bromo, el yodo y el elemento radiactivo, el astato, constituyen la família de elementos denominados Halógenos. Excepto el astato, las propiedades físicas y químicas de estos elementos han sido objeto exhaustivo de estudio. Ocupan el grupo VII en la tabla periódica y presentan una gradación casi perfecta de propiedades físicas. la familia de los halogenos se relaciona por la similitud de las propiedades químicas de los elementos, una similitud que esta asocíada con la disposición de los 7 electrones en la órbita externa de la estructura atómica de cada uno del los elementos del grupo. Todos los miembros forman compuestos con el hidrógeno y la facilidad con que se realiza esta unión decrece a medida que aumenta el peso atómico del halógeno. De igual manera, la facilidad de formación de diferentes sales decrece a medida que aumenta el peso atómico del halógeno. Las propiedades de los ácidos halogenados y sus sales muestran una estrecha relación; la similitud es evidente en los compuestos orgánicos halogenados, si bien al aumentar la complejidad química, las características y las influencias de otros componentes de la molécula pueden enmascarar o modificar el grado de las propiedades.
Video introductorio de los Halógenos
Formulación
| Halogenos | Números de oxidación |
|---|---|
| Flúor | -1 |
| Cloro | -1,1,3,5,7 |
| Bromo | -1,1,3,5,7 |
| Yodo | -1,1,3,5,7 |
| Astato | ....... |
Nomenclatura con Prefijos
Para formular correctamente elementos halógenos con oxígeno tenemos que seguir los siguientes pasos:
- Se escriben en primer lugar el símbolo del oxígeno seguido del símbolo del Halógeno.
- Se intercambian los números de óxidacion de los dos elementos.
- Para nombrala se escribe los nombres de los elementos predecedidos de el nombre general de los Halógenos(Haluro de...) predecedido de los prefijos Mono-, Di-, etc.
Ejemplo:
- O3Cl2= Dicloruro de Trioxígeno
- O5I2= Diyoduro de Pentaoxígeno
- O Br2= Dibromuro de Oxígeno
- O7Cl2= Dicloruro de Heptaoxígeno
Historia de este elemento
La primera tabla periódica se suele atribuir al ruso Dimitri Mendeleiev, aunque Julius Lothar Meyer también hizo sus investigaciones aparte al igual que Alfred Werner fue el que ideo el orden de la tabla. La sal tambien es un elemento químico muy utilizado desde la antigüedad.
Proviene del griego hals, 'sal'; genes, 'nacido', en química, cinco elementos químicamente activos, estrechamente relacionados, el principal de ellos es el cloro; los otros tres son: el flúor, el bromo y el yodo, que forman el grupo 17 (o VIIA) de la tabla periódica de clasificación de los elementos químicos. El nombre halógeno, o formador de sal, se refiere a la propiedad de cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio). Todos los miembros del grupo tienen una valencia de -1 y se combinan con los metales para formar halogenuros (también llamados haluros), así como con metales y no metales para formar iones complejos. Los cuatro primeros elementos del grupo reaccionan con facilidad con los hidrocarburos, obteniéndose los halogenuros de alquilo.
Los halógenos, grupo de elementos químicos puros formado por el flúor, el cloro, el bromo, el yodo y el astato, componen el grupo VII A
Los elemento halógenos:
El Bromo
El bromo es un elemento perteneciente al grupo de halógenos y su aspecto es gas o líquido: marrón rojizo Sólido: metálico lustroso. El número atómico del bromo es el 35 y su símbolo químico es Br.
Características del Bromo
- El mayor uso de bromo es la creación de retardantes de llama. Cuando cuando esta sustancia se quema el bromo aísla el fuego del oxígeno causando que este se apague.
- Los compuestos de bromuro, en particular el bromuro de potasio, se utilizan en los círculos médicos como anti-convulsivos. También se utilizan los veterinarios. La mayoría de los países limitan seriamente el uso y la disponibilidad de las sales de bromo para uso humano debido al hecho de que causan disfunciones neurológicas.
- Las sustancias bromadas son ingredientes importantes de muchos medicamentos de venta libre y medicamentos con receta, como analgésicos, sedantes y los antiestamínicos. De hecho, los compuestos de bromo son los ingredientes activos en varios medicamentos que tratan la neumonía y la adicción a la cocaína. Actualmente, los medicamentos que contienen varios compuestos de bromo están en ensayos para el tratamiento de la enfermedad de Alzheimer y las nuevas generaciones de la lucha contra el cáncer y medicamentos contra el SIDA.
- El bromuro procedente del calcio, sodio y zinc se utiliza para crear soluciones especiales para la perforación de sal.
El Yodo
El yodo es un elemento perteneciente al grupo de halógenos y su aspecto es violeta (Gas) Gris violáceo (Sólido). El número atómico del yodo es el 53 y su símbolo químico es I.
El Flúor
El flúor es el elemento más electronegativo y reactivo y forma compuestos con prácticamente todo el resto de elementos, incluyendo los gases nobles Xenón y Radón. Su símbolo es F
Características del Flúor
- El politetrafluoroetileno (PTFE), también denominado teflón, se obtiene a través de la polimerización de tetrafluoroetileno que a su vez es generado a partir de clorodifluorometano, que se obtiene finalmente a partir de la fluoración del correspondiente derivado halogenado con fluoruro de hidrógeno (HF).
- También a partir de HF se obtienen clorofluorocarburos (CFCs), hidroclorofluorocarburos (HClFCs) e hidrofluorocarburos (HFCs).
- Se emplea flúor en la síntesis del hexafluoruro de uranio, UF6, que se emplea en el enriquecimiento en 235U.
- El fluoruro de hidrógeno se emplea en la obtención de criolita sintética, Na3AlF6, la cual se usa en el proceso de obtención de aluminio.
- Hay distintas sales de flúor con variadas aplicaciones. El fluoruro de sodio, NaF, se emplea como agente fluorante; el difluoruro de amonio, NH4HF2, se emplea en el tratamiento de superficies, anodizado del aluminio, o en la industria del vidrio; el trifluoruro de boro, BF3, se emplea como catalizador; etc.
- Algunos fluoruros se añaden a las pastas de dientes para la prevención de caries.
- En algunos países se añade fluoruro a las aguas potables para prevenir la aparición de caries.
- Se emplea flúor monoatómico en la fabricación de semiconductores.
- El hexafluoruro de azufre, SF6, es un gas dieléctrico con aplicaciones electrónicas. Este gas contribuye al efecto invernadero y está recogido en el Protocolo de Kioto.
- El hexafluoruro de uranio es el gas más pesado conocido, aparte de ser la principal materia prima para la obtención de uranio enriquecido.
El Cloro
El cloro pertenece al grupo de los halogenos,su numero atómico es 17 y el símbolo con el que se representa el Cl.En condiciones normales y en estado puro forma dicloro: un gas tóxico amarillo-verdoso.
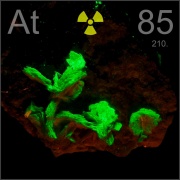
El Astato
El comportamiento químico de este elemento altamente radiactivo es muy similar al de otros halógenos, especialmente el yodo. El astato, seguido del francio, es el elemento más raro de la naturaleza, con una cantidad total sobre la superficie terrestre menor de 25 gramos en el mismo instante de tiempo. fue sintetizado por primera vez en 1940 por Dale R. Corson, K. R. MacKenzie y Emilio Segrè en la Universidad de Berkeley (California), bombardeando bismuto con partículas alfa. El símbolo del Astato es (At)
Ejemplos
Los compuestos del oxígeno con los halógenos sólo se pueden formular mediante la nomenclatura con prefijos multiplicadores. De este tipo de compuestos existen muy pocos concretamente cinco estos son: el Flúor, el Cloro, el Bromo, el Yodo y el Astato. Estos compuestos constituyen a la familia de los halógenos. Excepto el Astato que es un elemento radiactivo, las propiedades físicas y químicas de estos elementos han sido objeto exhaustivo y protagonista de un estudio científico. Presentan una grabación casi perfecta de propiedades físicas, estos elementos ocupan el grupo VII en la tabla periódica.
Fuentes de Información
- Merwill Uzcategui (15/5/2009). Carbono. Carbono. Análisis de los compuestos orgánicos. Consultado el 17 de enero de 2014. En: [[1]]
- "Ministerio de Empleo y Seguridad Social". Propiedades de los halogénos y sus compuestos. Enciclopedia de salud y seguridad en el trabajo. Consultado el 27 de enero de 2014 http://www.empleo.gob.es/es/publica/pub_electronicas/destacadas/enciclo/general/contenido/tomo4/104-07.pdf
- Cloro (11/02/2014). Wikipedia: La enciclopedia libre. [[2]]. Consultado el 11 de Febrero de 2014. En: http://es.wikipedia.org/wiki/Cloro
- Marco Gonzales (1/4/2013).http://www.youtube.com/watch?v=QotzCV-hVLM. Consultado el 25 de Marzo del 2014