Práctica. Física y Química. N15. E. Sales. 2013
Contents |
Definición
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa). Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más agua, lo que se denomina neutralización.
Metales y no metales
| METALES | |
|---|---|
| Números de oxidación | Elementos |
| +1 | Li, Na, K, Rb, Cs y Ag |
| +2 | Be, Mg, Ca, Sr, Ba, Zn, Cd |
| +3 | Al |
| +1, +2 | Cu y Hg |
| +1, +3 | Au |
| +2, +3 | fe, Co, Ni |
| +2, +3 +6 | Cr |
| +2, +3, +4, +6, +7 | Mn |
| +2, +4 | Pt, Pb, Sn |
| NO METALES | |
| Número de oxidación | Elementos |
| -1 | F |
| -1, +1 | H |
| -2 | O |
| +3 | B |
| -2, +4, +6 | S, Se, Te |
| -3, +3, +5 | P, As, Sb |
| -3, +1, +2, +3, +4, +5 | N |
| -4, +4 | Si |
| -4, +2, +4 | C |
| -1, +1, +3, +5, +7 | Cl, Br, |
Formulación y nomenclaturas
Para formular las sales se escribe primero el símbolo del metal con el número de oxidación del no metal como subíndice, seguido del símbolo del no metal con el número de oxidación del metal. El metal puede encontrarse con cualquiera de sus números de oxidación, sin embargo el no metal actúa únicamente con el negativo.
En la nomenclatura con prefijos multiplicadores se utilizan los prefijos numerales griegos para indicar el número de átomos que hay de metal y no metal. Estos prefijos son: Mono-, Di-, Tri-, Tetra-, Penta-, Hexa- y Hepta-.
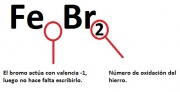
- FeBr2 -------- Dibromuro de hierro
- NiCl3 -------- Tricloruro de níquel
- LiI -------- Yoduro de litio
En la nomenclatura de los números de oxidación en números romanos se escribe el nombre del compuesto seguido del número de oxidación entre paréntesis del metal.
- FeBr2 -------- Bromuro de hierro (II)
- NiCl3 -------- Cloruro de níquel (III)
- LiI -------- Yoduro de litio
Tabla
| FÓRMULA | CON PREFIJOS
MULTIPLICADORES |
CON NUMERO DE OXIDACIÓN
EN NÚMEROS ROMANOS |
|---|---|---|
| FeCl3 | Tricloruro de hierro | Cloruro de hierro (III) |
| NaCl | Cloruro de sodio | Cloruro sódico |
| CuBr2 | Dibromuro de cobre | Bromuro de cobre (II) |
| AlCl3 | Tricloruro de aluminio | Cluroro de aluminio (III) |
| TeCa | Telururo de calcio | Telururo de calcio |
| FeCl2 | Dicloruro de hierro | Cloruro de hierro (II) |
| Ni2S | Disulfuro de níquel | Sulfuro de níquel (II) |
| Au3S | Trisulfuro de oro | Sulfuro de oro (III) |
| CaF | Floruro de calcio | Fluoruro de calcio |
| FeS | Sulfuro de hierro | Sulfuro de hierro (II) |
| CoCl3 | Tricloruro de cobalto | Cloruro de cobalto (III) |
| KCl | Cloruro de potasio | Cloruro de potasio |
| CaCl2 | Dicloruro de calcio | Cloruro de calcio (II) |
| BaCl2 | Dicloruro de bario | Cloruro de bario (II) |
| HgI2 | Diyoduro de mercurio | Yoduro de mercurio (II) |
| SnS | Sulfuro de estaño | Sulfuro de estaño (II) |
| FeCl3 | Tricloruro de hierro | Cloruro de hiero (III) |
| MnBr3 | Tribromuro de manganeso | Bromuro de manganeso (III) |
| PbCl2 | Dicloruro de plomo | Cloruro de plomo (II) |
| KBr | Bromuro de potasio | Bromuro de potasio |
| CaF2 | Difluoruro de calcio | Fluoruro de calcio (II) |
| Fe2S3 | Trisulfuro de dihierro | Sulfuro de hierro (III) |
| AlF3 | Trifluoruro de aluminio | Floruro de aluminio (III) |
Nuestro experimento (vídeo)
Fuentes de información
- Garrido, María Jesús. Práctica. Física y Química. N15. E. Sales. 2013. Consultado el 6 de febrero de 2014. En: https://docs.google.com/file/d/0B1DLmCdkVW6rV0Q3LWJlWXVSeFE/edit?pli=1
- Adriana. (15-03-2013). 10ejemplos.com. 10ejemplosdesales.com. Consultado el 9 de enero de 2014. En: http://10ejemplos.com/category/quimica